Memahami Rumus Kenaikan Titik Didih Suatu Larutan

Titik didih adalah suhu ketika tekanan uap air jenuh sama dengan tekanan udara luar. Dalam sebuah eksperimen, jika volume tertentu air dipanaskan pada tekanan 1 atm maka air akan mendidih pada suhu 100 0 C. Suhu tidak berubah meski air tetap dipanaskan.
Hal ini terjadi karena kalor dipakai untuk mengubah fase air dari cair menjadi uap air. Sifat titik didih ini dipakai untuk menentukan molekul relatif suatu zat yang terlarut.
Contoh kenaikan titik didih yaitu menggarami daging rebus setelah air mendidih. Contoh lain ketika memasukkan garam dalam air hangat. Garam akan terionisasi menjadi Na+ dan Cl-, menyebabkan tegangan permukaan air menjadi besar. Hal ini membantu membuka pori-pori kulit menjadi lebar ketika disiramkan campuran air garam. rumus kenaikan titik didih adalah selisih antara titik didih larutan dan titik didih pelarut
Rumus Kenaikan Titik Didih
Proses kenaikan titik didih dimulai dengan memanaskan sebuah zat. Contohnya ketika memanaskan air, ada partikel air yang berpisah membentuk uap air. Proses ini membuat kenaikan tekanan zat cair. Proses pendidihan terjadi ketika tekanan zat cair sama dengan tekanan lingkungan luar.
Kenaikan titik didih terjadi dalam zat terlarut seperti gula pasir. Partikel gula pasir ketika air dipanaskan, dapat menghambat proses penguapan. Mengutip dari Ruangguru.com, supaya tekanan uap air sama dengan tekanan udara luas dibutuhkan temperatur besar. Sehingga zat terlarut yang ditambahkan membuat titik didih larutan naik.
Dari penjelasan diatas, dirumuskan kenaikan titik didih larutan air adalah selisih antara titik didih larutan dan titik didih pelarut. Rumusnya yaitu:
∆Tb = Tb(larutan) – Tb(pelarut)
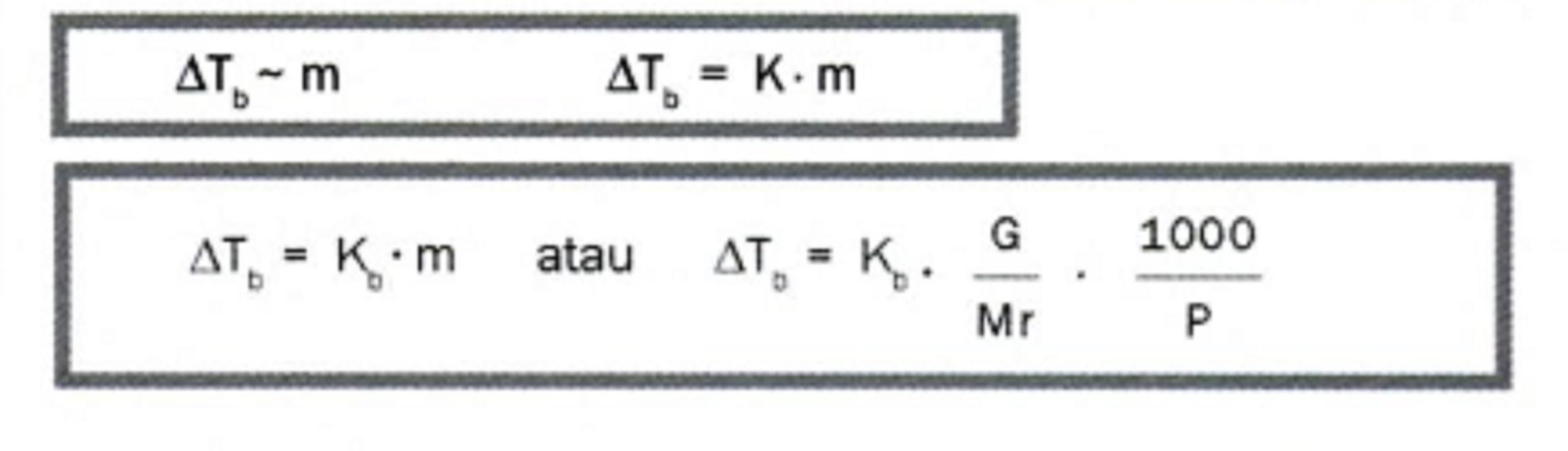
∆Tb = m . Kb
Keterangan:
∆Tb = kenaikan titik didih (boiling point elevation)
Tb = titik didih larutan (0C)
Tb0 = titik didih pelarut murni (0C)
m = molalitas (konsentrasi larutan)
Kb = tetapan kenaikan titik didih (oC kg/mol)
Beberapa percobaan menemukan kenaikan titik didih larutan tidak bergantung pada jenis zat pelarut. Tetapi zat bergantung pada jumlah konsentrasi (molalitas) partikel dalam larutan.
Rumus Kenaikan Titik Didih lainnya yaitu:
Keterangan:
∆Tb = kenaikan titik didih
Kb = tetapan kenaikan titik didih molal
m = molalitas larutan
G = massa zat terlarut dalam gram
Mr = massa molekul relatif zat terlarut
P = massa zat pelarut dalam gram
Contoh Soal Kenaikan Titik Didih
Diketahui zat X sebanyak 3 gram dilarutkan dalam 100 gram benzena. Kemudian menghasilkan larutan dengan kenaikan titik didih 0,540C. Jika diketahui kenaikan titik didih molal benzena sebesar 2,7. Berapa massa molekul relatif zat X tersebut?
Diketahui:
G = 3 gram
∆Tb = 0,540C
P = 100 gram
Kb = 2,7
Molalitas zat X = G/Mr x 1000/O
= 3/Mr X x 1000/100m
Kenaikan titik didih ∆Tb = m . Kb
0,540C = 2,7 x 30/ Mr X
Mr X = 150
Jadi, massa molekul relatif zat X sebesar 150