Memahami Rumus Molaritas dan Molalitas Serta Pembahasan Soal
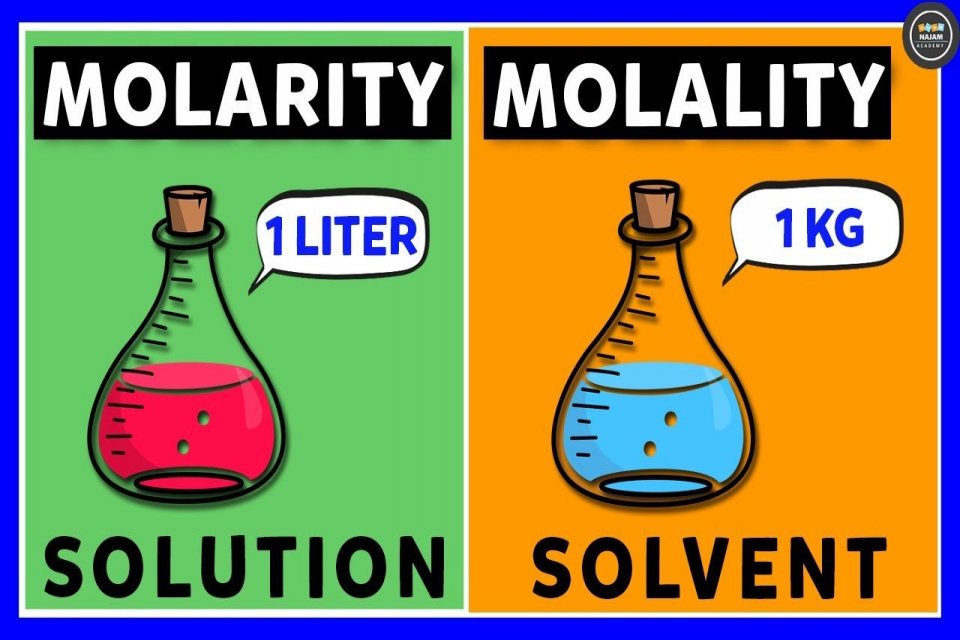
Molaritas adalah jumlah mol suatu zat yang bisa larut dalam setiap liter larutan. Molaritas termasuk satuan konsentrasi dalam Sistem Internasional (SI). Satuan molaritas yaitu mol/L atau molL-1. Artinya 1 mol zat terlarut apapun dalam 1 L pelarut memiliki konsentrasi 1,0 mol/L.
Contoh konsentrasi dalam tubuh yaitu hormon dan elektrolit. Keduanya termasuk zat berukuran kecil, sehingga menggunakan satuan milimol per liter (mmol/L). Satu milimol ini sama dengan 1/1000 mol, sehingga 0,001 mol/L sama dengan 1 mmol/L.
Contoh molaritas yaitu minuman berasa. Lidah merasakan minuman rasa asam, manis, hingga pahit. Rasa ini dihasilkan dari padatan yang dilarutkan dalam cairan. Misalnya saja rasa asam dari perasan jeruk nipis dicampur dengan air, atau gula yang dilarutkan dalam air.
Rumus Molaritas
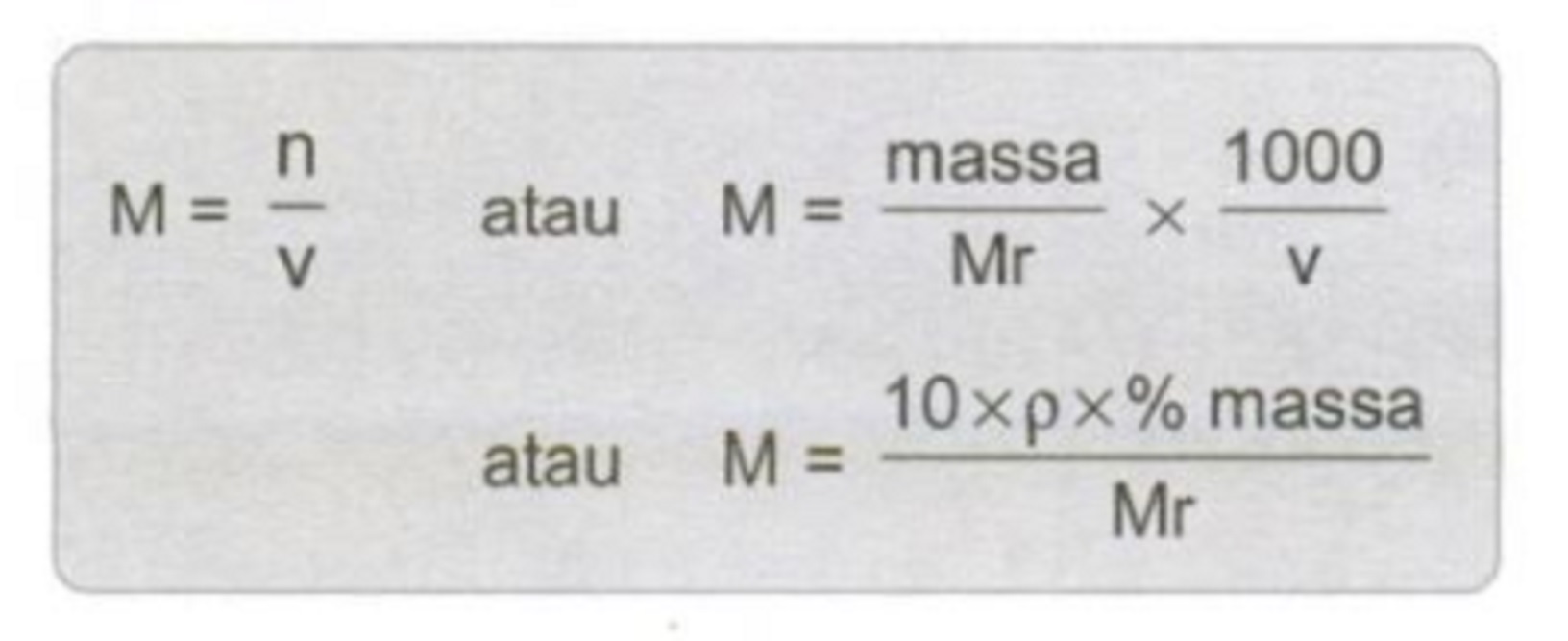
Molaritas termasuk konsentrasi larutan. Dari berbagai bentuk konsentrasi yang dipengaruhi sifat koligatif larutan yaitu molaritas, molalitas, dan fraksi mol. Satuan molaritas adalah mol/liter atau M. Rumus molaritas yaitu mol zat terlarut dibagi volume larutan. Tetapi, molaritas dapat dicari melalui massa jenis zat terlarut dan volume larutan.
Keterangan:
M = molaritas (Mol/liter)
V = volume larutan (liter)
Massa = massa zat terlarut (gram)
p = massa jenis (gram/ml atau kg/L)
% massa = persen massa zat terlarut (%)
n = mol zat terlarut
Rumus pengenceran larutan
Dalam buku Rumus Lengkap Kimia SMA, jika dilakukan pengenceran larutan, maka mol zat terlarut sebelum pengenceran = mol zat terlarut sesudah pengenceran.
Rumusnya yaitu:
mol 1 = mol 2
atau
V1M1 = V2M2
Keterangan:
V1 = volume sebelum pengenceran
M1 = molaritas sebelum pengenceran
V2 = volume sesudah pengenceran
M2 = molaritas sesudah pengenceran
Contoh Soal Molaritas dan Pembahasan
1. Diketahui NaOH sebanyak 10 gram dilarutkan dalam air, sehingga diperoleh 500 ml larutan NaOH (Mr = 40). Berapa kemolaran larutan tersebut?
M = massa/Mr x 1000/V
M= 10/40 x 1000/500
M = 0,5 M
2. Jika 20 ml HCL 5 M diencerkan menjadi 0,4 M. Berapa jumlah air yang harus ditambahkan pada larutan?
V1M1 = V2M2
20 x 5 = V2 x 0,4
V2 = 20 x 5 / 0,4
V2 = 250 ml
Rumus Molalitas (m)
Molalitas adalah jumlah mol yang bisa larut dalam 1 kg atau 1.000 gram pelarut. Perhitungan molalitas ini menunjukkan perbandingan antara jumlah zat pelarut dalam satuan berat kilogram zat pelarut. Satuan molalitas adalah mol/kg.
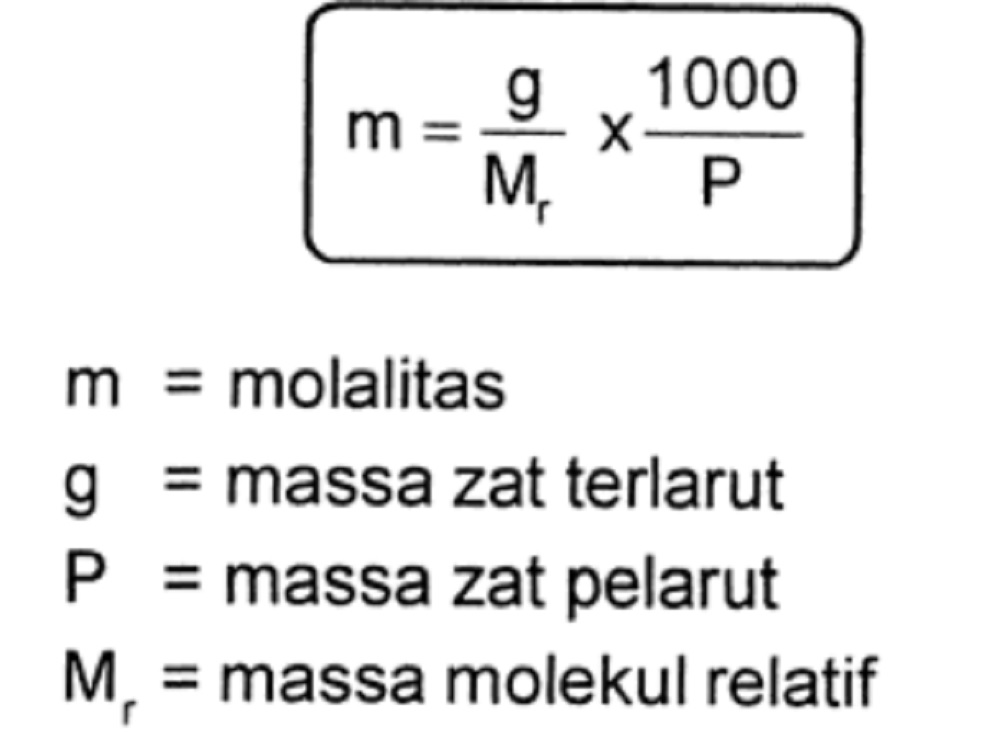
Rumus Molalitas yaitu
m = n/p
Keterangan:
m = molalitas (mol/kg)
n = mol zat terlarut
p = massa pelarut (gram atau kg)
Atau
Contoh Soal Molalitas dan Pembahasan
1. Dalam 250 gram air ditambahkan 17,1 gram larutan gula tebu. Diketahui Mr = 342. Berapa jumlah molalitas larutan?
Diketahui
g = 17,1 gram
Mr = 342
p = 250 gram
m = g/Mr x 1000/p
m = 17,1/ 342 x 1000/250
m = 0,2 mol
2. Massa garam dapur (NaCI) sebesar 10 gram. Garam tersebut memiliki massa molekul relatif sebesar 58,5 gram/ mol. Hitung mol dari gram!
Diketahui:
p = 10 gram
Mr = 58,5 gram/mol
mol = gram/Mr
mol = 10/58,5
mol = 0,17 mol
Demikian penjelasan mengenai rumus molaritas dan molaitas, disertai dengan contoh soalnya.