Mengenal Teori Atom Bohr dan Kekurangannya

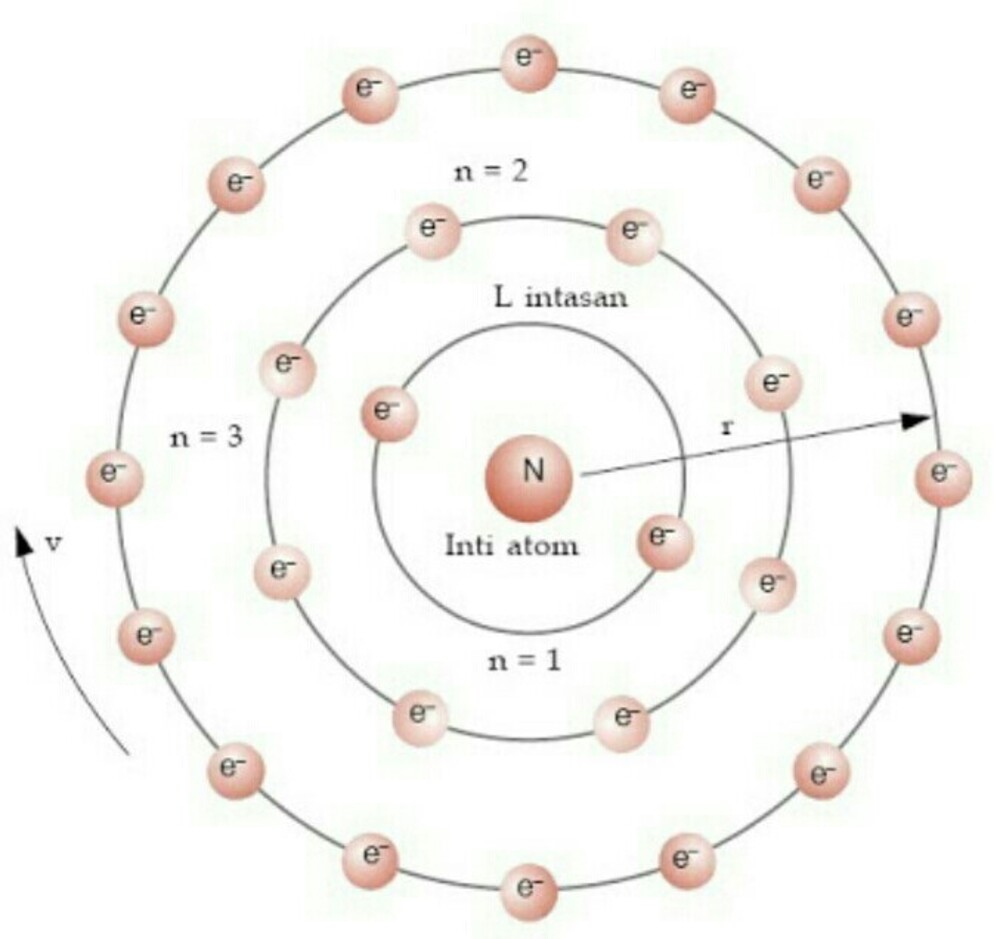
Posisi elektron yang terdapat di lintasan berdasarkan tingkat energinya ini kadang dikenal juga dengan rangkaian kulit-kulit elektron atom. Mengingat elektron dapat berpindah ke lintasan atau kulit lain, tentu ada juga sebab-akibat yang berlangsung selama prosesnya.
Menurut catatan Muchtaridi dan Sandri Justiana dalam Kimia 1 (2007:30), tingkatan energi pada teori atom Bohr mengisyaratkan beberapa baris lintasan yang diisi oleh elektron sebagai pengeliling atom. Elektron ini dapat berpindah dari sebuah lintasan ke lintasan lain melalui proses eksitasi dan deeksitasi.
Proses eksitasi ini dijabarkan sebagai kasus ketika tingkat energi pindah dari lintasan rendah ke tempat yang lebih tinggi. Biasanya, hal ini terjadi akibat adanya penyerapan energi. Sedangkan deeksitasi, dijelaskan sebagai perpindahan energi dari tingkat tinggi ke yang lebih rendah dari sebelumnya. Proses ini terjadi akibat adanya sebuah pemancaran energi.
Kekurangan Teori Atom Bohr
Teori Atom Bohr sudah menjelaskan kebaruan dalam penelitian atom, tetap terdapat kekurangan dari teori yang diungkapkannya.
- Jarak dan orbit yang ditekankan dalam model atom Bohr tidak sejalan dengan “Prinsip Ketidakpastian Heisenberg”, yakni jarak/radius tak bisa bersama dengan orbit.
- Teori atom Bohr juga tidak mampu memberikan jawaban atas Efek Zeeman, yaitu efek yang ketika garis spectrum terbagi-bagi akibat adanya sebuah medan magnet.
Kelebihan Teori Atom Bohr
- Dapat menerangkan kenapa elektron tidak jatuh ke inti atom
- Teori Atom Niels Bohr memperbaiki Teori Atom Rutherford yang tidak bisa menjelaskan mengapa elektron tidak jatuh ke inti atom.
Dilansir dari Chemistry LibreTexts, Bohr menjelaskan bahwa elektron tidak memancarkan energi saat mengorbit inti, tetapi ada dalam keadaan energi konstan yang disebut sebagai keadaan stasioner. Artinya, elektron berada dalam lintasan dengan tingkat energi yang tetap.
Tetapnya energi dalam suatu elektron tersebutlah alasan mengapa elektron yang bermuatan negatif tidak jatuh ke inti atom yang bermuatan positif. Dapat menjelaskan energi eksitasi dan deeksitasi elektron Teori Atom Bohr dapat menerangkan energi eksitasi dan deeksitasi saat elektron berpindah dalam suatu atom.
Mengutip Encyclopedia Britannica, Teori Atom Bohr menerangkan bahwa atom menyerap dan memancarkan radiasi hanya ketika elektron melompat di antara keadaan yang diizinkan. Ketika elektron berpindah, akan terjadi penambahan energi. Adapun ketika energi hilang, atom akan kembali ke keadaan dasarnya.
Energi yang hilang tersebut, lalu akan terpancar sebagai radiasi. Dilansir dari Lumen Learning, teori atom Bohr mampu menghitung setiap tingkat energi elektron sesuai dengan spektrum emisi atom hidrogen. Namun, model tersebut Bohr tersebut tidak dapat diterapkan dengan baik pada atom-atom yang lebih kompleks.
Pada atom dengan jumlah elektron banyak, perhitungan spektrum atom Bohr kerap kali menimbulkan penyimpangan. Kelemahan Teori Atom Bohr adalah hanya mampu menjelaskan spektrum atom sederhana seperti hidrogen dan tidak dapat menjelaskan atom-atom yang lebih kompleks.
Tidak bisa menjelaskan Efek Zeeman menjadi Kelemahan lain Teori Atom Bohr. Efek Zeeman adalah terpecahnya garis spektral atom menjadi dua atau tiga di bawah pengaruh medan magnet.